Νέα στοιχεία για τη λειτουργία των κυττάρων
26 Απριλίου 2014
Οι αυξητικοί παράγοντες είναι όμορφοι! Αυτή είναι μία 3D αναπαράσταση της δομής του αγγειακού ενδοθηλιακού αυξητικού παράγοντα (VEGF).
Ερευνητές του Τμήματος Βιοϊατρικών Ερευνών του Ινστιτούτου Μοριακής Βιολογίας και Βιοτεχνολογίας (ΙΜΒΒ) στα Ιωάννινα αποκάλυψαν ότι η σηματοδότηση των αυξητικών παραγόντων στα κύτταρα απαρτιώνει τον μηχανισμό απόκρισης στην παρουσία μη σωστά αναδιπλωμένων πρωτεϊνών (Unfolded Protein Response, UPR) στο ενδοπλασματικό δίκτυο (ER). Τα αποτελέσματα της έρευνας θα μπορούσαν να συμβάλλουν σημαντικά στην ανάπτυξη μελλοντικών θεραπευτικών παρεμβάσεων για πολλές σημαντικές ανθρώπινες ασθένειες. Πράγματι, η παθογένεια του καρκίνου, του διαβήτη, των αυτοάνοσων νοσημάτων και των νευροεκφυλιστικών ασθενειών, οι οποίες χαρακτηρίζονται από ελαττωματική αναδίπλωση πρωτεϊνών και συσσωμάτωση αυτών (Πάρκινσον, Αλτσχάιμερ, ALS), περιλαμβάνει έναν ορισμένο βαθμό στρες του ER που είναι σήμερα στο επίκεντρο της θεραπευτικής παρέμβασης προς αυτές τις ασθένειες.
Σχετικό άρθρο της ερευνητικής ομάδας του καθ. Θ. Φώτση, Karali et al, που έχει την έδρα της στο Τμήμα Βιοϊατρικών Ερευνών του Ινστιτούτου Μοριακής Βιολογίας και Βιοτεχνολογίας του ΙΤΕ, δημοσίευσε το ιδιαίτερα αναγνωρισμένο επιστημονικό περιοδικό Molecular Cell, στις 17 Απριλίου 2014 (http://www.cell.com/molecular-cell/). Η μελέτη αυτή δείχνει ότι το ER παίζει σημαντικό ρόλο σε φυσιολογικές λειτουργίες του κυττάρου, όπως είναι η σηματοδότηση από αυξητικούς παράγοντες, και δεν περιορίζεται μόνο στην προσαρμογή του κυττάρου στο στρες.
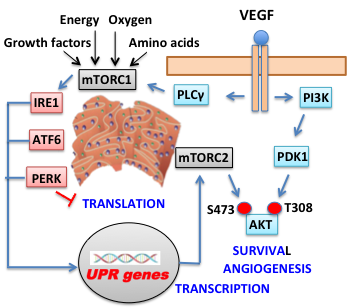
Το ER είναι η μεγαλύτερη ενδοκυτταρική δεξαμενή ιόντων ασβεστίου και είναι σημαντικό για τη βιογένεση των περοξυσωμάτων και αυτοφαγοσωμάτων. Επιπλέον, παίζει σημαντικό ρόλο σε μεταβολικές διεργασίες, όπως η νεογλυκογένεση, η σύνθεση λιπιδίων και η αναδίπλωση των πρωτεϊνών του εκκριτικού μονοπατιού. Το τελευταίο ως ρυθμιζόμενο από αλληλοσυνδεόμενα περιβαλλοντικά και κυτταρικά σήματα είναι δυνατό σε συνθήκες κυτταρικού στρες να οδηγήσει στη δημιουργία και συσσώρευση στο ER μη αναδιπλωμένων πρωτεϊνών, οι οποίες ξεκινούν την ενεργοποίηση των αλυσίδων μεταγωγής του σήματος από τις IRE1α, ATF6 και PERK ξεκινώντας τις μεταγραφικές/μεταφραστικές αποκρίσεις γνωστές ως UPR. Tα γονίδια-στόχοι της μεταγραφικής ρύθμισης αυξάνουν τη χωρητικότητα/δυνατότητα του ER σε αναδίπλωση πρωτεϊνών, ενώ ο έλεγχος της μετάφρασης σκοπό έχει να ελαττώσει το φορτίο του ER σε πρωτεΐνες. Αν και οι αποκρίσεις αυτές αποβλέπουν στην αποκατάσταση της ομοιοστασίας του ER και την επιβίωση του κυττάρου, η αδυναμία επαναφοράς της ομοιοστασίας που συνοδεύεται με παρατεταμένη UPR οδηγεί το κύτταρο σε αποπτωτικό θάνατο.
Το άρθρο των Karali et al δείχνει ότι το ER παίζει σημαντικό ρόλο στη σηματοδότηση από τον VEGF. Δύο πρωτεϊνικά συμπλέγματα, το mTORC1 και το mTORC2, και οι τρεις ενεργοποιητές της UPR (IRE1α, ATF6 και PERK) εντοπίζονται στις μεμβράνες του ER και ενσωματώνονται στη σηματοδοτική μηχανή του VEGF. O VEGF ενεργοποιεί τις IRE1α, ATF6 και PERK διαμέσου αλληλεπίδρασης της PLCγ με το σύμπλεγμα mTORC1 χωρίς την ανάγκη συσσώρευσης μη αναδιπλωμένων πρωτεϊνών και ΕR στρες. Η ενεργοποίηση των ATF6 και PERK συνεισφέρει στην επιβίωση των ενδοθηλιακών κυττάρων (ΕC) από τον VEGF επάγοντας την φωσφορυλίωση της ΑΚΤ στη Ser473, η οποία είναι απαραίτητη για την πλήρη αντι-αποπτωτική δραστικότητα της ΑΚΤ. Παράλληλη αστάθεια του mRNA και της πρωτεΐνης της προ-αποπτωτικής CHOP επιτρέπει στα EC να αποφεύγουν τον αποπτωτικό θάνατο. Αποσιώπηση των γονιδίων PLCγ, ATF6 ή eIF2α αναστέλλει δραματικά την δημιουργία νέων αγγείων σε βύσματα από Matrigel σε ποντίκια αποδεικνύοντας ότι το ER και ο μηχανισμός της UPR ενσωματώνονται στα σηματοδοτικά κυκλώματα του VEGF που ρυθμίζουν την επιβίωση των ενδοθηλιακών κυττάρων και την αγγειογένεση επεκτείνοντας το ρόλο τους πέραν της προσαρμογής στο ER στρες.
Τα ευρήματα αυτά δείχνουν ότι ο μηχανισμός της UPR δεν είναι αποκλειστικό εργαλείο για την αντιμετώπιση του ER στρες και τη συσσώρευση μη αναδιπλωμένων πρωτεϊνών, αλλά συμμετέχει σε φυσιολογικές καταστάσεις, όπως η σηματοδότηση του VEGF. Αυτό είναι ένα νέο και βασικό μονοπάτι, που συνδέει σηματοδοτικά γεγονότα με το μηχανισμό της UPR και τις μεταβολικές/βιοσυνθετικές διεργασίες του κυττάρου. Η εμπλοκή των mTORC1 και mTORC2 υποστηρίζει επίσης αυτή την άποψη. Φαίνεται ότι η απόκριση των ενδοθηλιακών κυττάρων σε εξωκυτταρικά σήματα, όπως η παρουσία του VEGF, συντονίζεται με τα επίπεδα ενέργειας και θρεπτικών συστατικών των κυττάρων διαμέσου μεταβολικών αισθητήρων, όπως το σύμπλεγμα mTORC1, για να επιφέρει προσαρμοσμένες μεταγραφικές και μεταφραστικές ρυθμίσεις διαμέσου επιλεγμένων συστατικών του μηχανισμού της UPR.
Η περαιτέρω κατανόηση των μηχανισμών με τους o VEGF χρησιμοποιεί τους μηχανισμούς της UPR για να επιτύχει την επιβίωση των κυττάρων με την ενσωμάτωση επίσης των σημείων ελέγχου του συμπλέγματος mTORC1 που ανιχνεύουν την μεταβολική κατάσταση του κυττάρου μπορεί να βοηθήσει στη διευκρίνιση των μηχανισμών που διέπουν τις διάφορες κυτταρικές τύχες που υποστηρίζονται από το μηχανισμό της UPR (απόπτωση, επιβίωση, διαφοροποίηση).
ΠΕΡΙΣΣOΤΕΡΕΣ ΠΛΗΡΟΦΟΡIΕΣ: Καθηγητής Θεόδωρος Φώτσης, Τμήμα Βιοϊατρικών Ερευνών, ΙΜΒΒ, ΙΤΕ, 45110 Iωάννινα, ή Εργαστήριο Βιολογικής Χημείας, Ιατρική Σχολή, Πανεπιστήμιο Ιωαννίνων, 45110, Ιωάννινα (Tel.: +30 2651007560; Email: [email protected], http://www.bri.forth.gr/fotsis_murphy.html )