Γιατί ο Υδράργυρος είναι υγρός; Μας το εξηγεί η Σχετικότητα!
14 Σεπτεμβρίου 2013Όλοι γνωρίζουμε ότι το υγρό που περιέχεται στα παλιά θερμόμετρα λέγεται Υδράργυρος. Αρκετοί γνωρίζουμε ότι πρόκειται στην πραγματικότητα για μια επικίνδυνη ουσία και αν σπάσει ένα τέτοιο θερμόμετρο, θα πρέπει να μαζευτούν αμέσως και με πολλή προσοχή τα κομμάτια-μικρές μπίλιες, στις οποίες διασκορπίζεται ο υδράργυρος, για να μην καταποθούν, να μην έλθουν σε επαφή με το σώμα μας και να μην τις εισπνεύσουμε, λόγω της γρήγορης εξάτμισής τους. Λιγότεροι μάλλον γνωρίζουμε ότι ο υδράργυρος είναι ένα μέταλλο, δηλαδή ανήκει στην ίδια κατηγορία με το χρυσό, το σίδηρο κ.λπ., αλλά εμφανίζει σημαντικές διαφορές από τα υπόλοιπα μέταλλα: δεν είναι τόσο δραστικός, δεν οξειδώνεται τόσο εύκολα και δεν είναι τόσο καλός αγωγός της θερμότητας και του ηλεκτρισμού. Η πιο εντυπωσιακή διαφορά του είναι οπωσδήποτε το γεγονός ότι σε θερμοκρασία (και πίεση) δωματίου, ο υδράργυρος εμφανίζεται σε υγρή μορφή. Γιατί όμως συμβαίνει αυτό;
Ήδη από χρόνια είχε προταθεί ως πιθανότερη αιτία για την ιδιομορφία αυτή, η επίδραση σχετικιστικών φαινομένων στα ηλεκτρόνια των ατόμων του υδραργύρου[1]. Ας δούμε όμως λίγο πιο αναλυτικά, τι ακριβώς σημαίνει αυτό. Όπως γνωρίζουμε, κάθε άτομο αποτελείται από ένα πυρήνα γύρω από τον οποίο περιφέρονται ηλεκτρόνια. Καθώς ο πυρήνας του υδραργύρου είναι αρκετά μεγάλος, και το φορτίο του είναι αντίστοιχα μεγάλο, οπότε τα ηλεκτρόνια θα πρέπει να αναπτύσσουν μεγάλες ταχύτητες, για να μην πέσουν πάνω του. Σύμφωνα με τη Θεωρία της Σχετικότητας, από την άλλη, όταν ένα σώμα κινείται σε πολύ μεγάλες ταχύτητες (συγκρίσιμες με την ταχύτητα του φωτός, που είναι περίπου 300.000 χιλιόμετρα το δευτερόλεπτο), αυξάνεται η μάζα του, δηλαδή γίνεται πιο «βαρύ». Αυτό ακριβώς παθαίνουν τα ηλεκτρόνια του υδραργύρου που βρίσκονται πιο κοντά στον πυρήνα[2], τα οποία έτσι ελαττώνουν την ακτίνα και την ενέργειά τους[3], με αποτέλεσμα τα άτομα να αναπτύσσουν εντονότερους δεσμούς στο εσωτερικό τους και χαλαρότερους δεσμούς μεταξύ τους. Επιπλέον, τα εξωτερικά ηλεκτρόνια των ατόμων του υδραργύρου είναι «απρόθυμα» να εμπλακούν σε δεσμούς με άλλα άτομα[4]. Όταν σε ένα στοιχείο οι δεσμοί μεταξύ των ατόμων δεν είναι τόσο ισχυροί, αυτό έχει ως συνέπεια οι συνενώσεις των ατόμων του να εμφανίζουν υγρή μορφή[5].
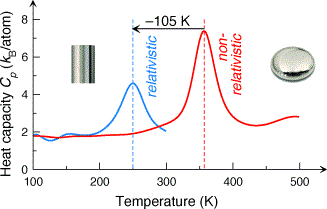
Πρόσφατα, δημοσιεύθηκε μια εργασία που περιγράφει την έρευνα, η οποία τελικά επιβεβαιώνει αυτή την υπόθεση[6]. Σύμφωνα με αυτήν, αν δεν ληφθούν υπόψη τα σχετικιστικά φαινόμενα, το σημείο τήξης[7] του υδραργύρου θα έπρεπε να ήταν γύρω στους 820C [8], ενώ λαμβάνοντας υπόψη τις σχετικιστικές επιδράσεις το σημείο τήξης υπολογίζεται στους -23οC, τιμή που είναι αρκετά κοντά στην παρατηρούμενη (περίπου -39 οC)[9]. Οι ερευνητές αναφέρουν τους πολύπλοκους υπολογισμούς που χρειάστηκε να γίνουν, καθώς το πλήθος των ηλεκτρονίων του υδραργύρου είναι πολύ μεγάλο (80). Η δυσκολία του εγχειρήματος καταδεικνύεται και από το γεγονός ότι οι υπολογισμοί χρειάστηκαν περί τις 2 δεκαετίες για να ολοκληρωθούν…[10]
Η μέθοδος που ακολούθησε η ερευνητική ομάδα πιστεύεται ότι θα «ρίξει φως» σε ανάλογα ζητήματα, όπως είναι τα σημεία τήξης άλλων μεταλλικών συστημάτων.
Ας σημειωθεί, επίσης, ότι σε αντίστοιχα σχετικιστικά φαινόμενα οφείλεται η χαρακτηριστική λάμψη του χρυσού και του αργύρου, καθώς και η ηλεκτρική τάση που δίνουν οι μπαταρίες αυτοκινήτου.
[1] Κυρίως από το έργο του Φιλανδού χημικού Pekka Pyykkö, κατά τις δεκαετίες του 1960 και 1970.
[2] Τα λεγόμενα s ηλεκτρόνια (δηλ. του s-τροχιακού) και περισσότερο τα λεγόμενα 1s ηλεκτρόνια. Για την ακρίβεια, σύμφωνα με την Κβαντομηχανική, αυτά έχουν τη μεγαλύτερη πιθανότητα να βρεθούν κοντά στον πυρήνα.
[3] Υπολογίζεται, συγκεκριμένα, ότι αποκτούν το 58% της ταχύτητας του φωτός, γεγονός που κάνει τη μάζα τους 1,23 φορές μεγαλύτερη.
[4] Ειδικότερα τα λεγόμενα 6s ηλεκτρόνια Ουσιαστικά, αυτό που συμβαίνει είναι ότι τα ηλεκτρόνια αυτά συνδέονται περισσότερο με το άτομο στο οποίο ανήκουν, παρά με άλλα άτομα. Τελικά, τα άτομα συνδέονται μεταξύ τους με τις δυνάμεις van der Waals, που οφείλονται σε τοπικές διακυμάνσεις φορτίου γειτονικών ατόμων και είναι ασθενέστερες.
[5] Το ίδιο φαινόμενο συμβαίνει και σε άλλα στοιχεία, αλλά στον υδράργυρο είναι πιο έντονο.
[6] Βλ. Florent Calvo, Elke Pahl, Michael Wormit, Peter Schwerdtfeger, «Evidence for Low-Temperature Melting of Mercury owing to Relativity», Angewandte Chemie, International Edition, Vol. 52, Iss. 29, pp. 7583–7585, July 15, 2013. Οι ερευνητές προέρχονται από τη Νέα Ζηλανδία, τη Γερμανία και τη Γαλλία. Η διαδικτυακή δημοσίευση της εργασίας έγινε αρχικά στις 18 Ιουνίου 2013.
[7] Σημείο τήξης ονομάζουμε τη θερμοκρασία στην οποία ένα στοιχείο παύει να είναι στερεό και μετατρέπεται σε υγρό.
[8] Η οποία είναι και πάλι μια πολύ χαμηλή θερμοκρασία, συγκρινόμενη με αυτήν των συνηθισμένων μετάλλων, τα οποία κυμαίνονται από εκατοντάδες βαθμούς Κελσίου και φτάνουν τους χιλιάδες βαθμούς Κελσίου.
[9] Αυτό που μελετήθηκε, για την ακρίβεια, ήταν η θερμοχωρητικότητα του υδραργύρου, ένα μέγεθος που δείχνει πόσο εύκολα θερμαίνεται ή ψύχεται ένα υλικό και μεταβάλλεται ραγδαία όταν ένα υλικό αλλάζει φάση (λ.χ. από στερεό γίνεται υγρό).
[10] Οι ερευνητές εκτιμούν ότι τα τελευταία χρόνια οι τεχνικές δυνατότητες υπολογισμού βελτιώθηκαν θεαματικά και αυτό επιτάχυνε την περάτωση της προσπάθειάς τους.